Ectopic se referă la un obiect sau țesut uman care se formează sau este localizat acolo unde nu aparține. Formarea osoasă ectopică constă în stabilirea de noi materiale osoase (printr-un proces numit osificare) în zone, din nou, unde acest material nu aparține. Acest proces de osificare este realizat de celule numite osteoblaste. ◊ Cuvântul ectopic provine de la greci și înseamnă "departe de un loc". Antonimul său, care este os "ortotopic" – derivat de asemenea din greacă – se referă la oase care se formează în poziția sa anatomică corectă, conform lui Scott et .
al., În articolul lor intitulat "Scurtă revizuire a modelelor de formare osoasă ectopică". Articolul a fost publicat în numărul din martie 2012 al revistei,
Stem Cells Development. Formarea osului ectopic poate fi prezentă la naștere, se datorează geneticii sau poate apărea ca o complicație a anumitor afecțiuni medicale, cum ar fi paraplegia și / sau rănirea traumatică (pentru a menționa doar câteva). Scott, et. Al. spun ca formarea osoasa ectopica este considerata a fi provocata de inflamatia locala urmata de strangerea celulelor progenitoare scheletice. Potrivit site-ului Spitalului de Copii din Boston, o celulă progenitoare este asemănătoare unei celule stem, cu excepția faptului că este mai limitată în ceea ce privește tipurile de celule pe care le poate deveni pe măsură ce acestea se împart. Celulele progenitoare provin din celule stem, dar nu sunt celule stem adulte.
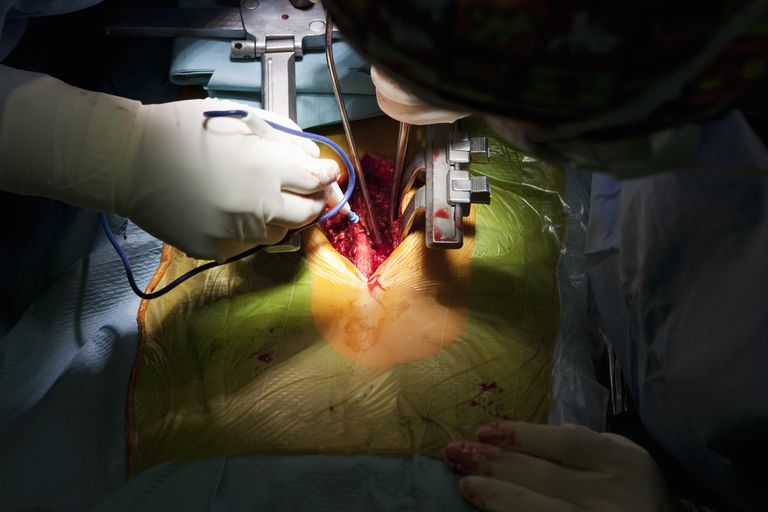
Formarea ectopică a oaselor datorată intervenției chirurgicale spinale
Scott, et. al, spun ca pana la 10% dintre pacientii care au suferit interventii chirurgicale invazive – si chirurgia spate cu siguranta se incadreaza in acest grup – va dezvolta ectopic formarea osoasa.
În coloana vertebrală, termenul "formarea osoasă ectopică" este uneori folosit pentru a descrie țesutul osos nedorit care se pune în canalul spinal. În 2002, FDA a aprobat o proteină osoasă produsă de Medtronic numită Infuse pentru utilizare în chirurgia lombară a coloanei vertebrale. Criteriile de utilizare specificate de FDA au fost foarte specifice: ca grefă osoasă pentru un singur nivel Fusion intermedial lombar anterioară (ALIF) în cadrul sistemului dispozitivului de fuziune cu bandă lombară (LT-Cage.) Whew!
Dar la scurt timp dupa aprobare, multi chirurgi au inceput sa foloseasca materialul "off-label", ceea ce inseamna alte scopuri decat cele aprobate de FDA. Utilizările neetichetate includ intervenția chirurgicală a coloanei vertebrale cervicale care a dus la apariția unui număr de "reacții adverse" sau AE fiind raportate la FDA. Formarea osoasă ectopică a fost una dintre AE, dar lista a inclus alte lucruri foarte grave, cum ar fi arahnoidita, deficite neurologice crescute, ejaculare retrogradă, cancer și multe altele. Deloc dragut!
Raportul Sentinal Watchdog din Jurnalul Milwaukee, care a urmat această poveste din 2011 (și continuă să facă acest lucru), spune că în primele săptămâni de la primul studiu clinic pentru Infuze, formarea ectopică a osului a fost găsită la 70% dintre pacienții din studiu . Unii dintre acești pacienți au necesitat una sau mai multe intervenții chirurgicale pentru a corecta osul nedorit și / sau complicațiile medicale care au apărut din acesta.
În revizuirea probelor publicate în numărul din 2013 al
Chirurgie Neurologică Internațională
, Epstein a comparat cele 13 studii care au alimentat studiile industriale cu alte studii publicate ulterior în reviste, precum și documente și informații FDA situate în baze de date. Ea raportează că a găsit "evenimente adverse nedorite inițial și inconsecvențe interne" cu studiile Infuse. Ea raportează, de asemenea, că 40% din evenimentele adverse au fost atribuite ALIF (operația de gât "în afara etichetei" care a fost făcută), adăugând că unele dintre aceste evenimente au fost în pericol viața.Între timp, Milwaukee Jurnalul Sentinel raportează că Medtronic fie a sub-raportat, fie nu a raportat deloc aceste efecte adverse la FDA într-un raport din 2004 scris de Medtronic, finanțat de medici. MJS spune ca "doctorii care au scris hartia din 2004 vor primi milioane de dolari in redevente si alte plati de la Medtronic". In mai 2014, MJS a urmarit aceasta poveste cu un alt articol, spunand ca Medtronic a fost de acord sa plateasca 22 milioane dolari pentru a soluționa 1000 de reclamații împotriva lor Infuse.
Povestea a menționat, de asemenea, că Medtronic anulează alte 140 de dolari pentru a acoperi "pretențiile preconizate"

